pH
wielkość stosowana do określania odczynu roztworu;
[łac. potentium hydrogeni],
wykładnik jonów wodorowych,
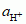 , gdzie a jest aktywnością (stężeniem) jonu wodorowego, wyrażoną w mol/kg, odniesioną do stanu standardowego wynoszącego 1 mol/kg. W rozcieńczonych roztworach wodnych pH przyjmuje wartości 0–14; jest to konsekwencją reakcji dysocjacji elektrolitycznej wody: H2O ⇄ H+ + OH−, opisanej iloczynem jon. wody K = [H+][OH−] = 10−14; podobnie odczyn roztworu można określać wykładnikiem jonów wodorotlenkowych, zw. pOH, pOH = 14 − pH. Inne zakresy wartości pH występują w roztworach bardzo stężonych lub w rozpuszczalnikach innych niż woda. Znajomość pH ma podstawowe znaczenie w badaniach biomed. (np. pH krwi zawiera się w granicach 7,36–7,44), farmacji, ochronie środowiska, gleboznawstwie, kontrolowanym prowadzeniu procesów chem. w laboratoriach i w przemyśle oraz w wielu innych dziedzinach. Do przybliżonego określenia wartości pH stosuje się roztwory wskaźników, papierki wskaźnikowe, a do dokładnego pehametry.
, gdzie a jest aktywnością (stężeniem) jonu wodorowego, wyrażoną w mol/kg, odniesioną do stanu standardowego wynoszącego 1 mol/kg. W rozcieńczonych roztworach wodnych pH przyjmuje wartości 0–14; jest to konsekwencją reakcji dysocjacji elektrolitycznej wody: H2O ⇄ H+ + OH−, opisanej iloczynem jon. wody K = [H+][OH−] = 10−14; podobnie odczyn roztworu można określać wykładnikiem jonów wodorotlenkowych, zw. pOH, pOH = 14 − pH. Inne zakresy wartości pH występują w roztworach bardzo stężonych lub w rozpuszczalnikach innych niż woda. Znajomość pH ma podstawowe znaczenie w badaniach biomed. (np. pH krwi zawiera się w granicach 7,36–7,44), farmacji, ochronie środowiska, gleboznawstwie, kontrolowanym prowadzeniu procesów chem. w laboratoriach i w przemyśle oraz w wielu innych dziedzinach. Do przybliżonego określenia wartości pH stosuje się roztwory wskaźników, papierki wskaźnikowe, a do dokładnego pehametry.