dysocjacja elektrolityczna,
samorzutny proces rozpadu cząsteczek elektrolitów (kwasów, zasad, soli) w roztworach na dodatnio i ujemnie naładowane cząstki, tj. jony;
dysocjacja elektrolityczna
Encyklopedia PWN
proces dysocjacji elektrolitycznej jest korzystny energetycznie, gdyż jony w roztworze przyciągają dipole cząsteczek rozpuszczalnika (solwatacja); roztwory, w których nastąpiła dysocjacja elektolityczna przewodzą prąd elektryczny, przy czym przewodzenie prądu polega na przenoszeniu ładunków elektrycznych przez jony wędrujące w polu elektrycznym; elektrolity mocne (np. NaCl) niezależnie od stężenia ulegają całkowitej dysocjacji elektrolitycznej, czyli wszystkie ich cząsteczki są zdysocjowane na jony; elektrolity słabe (np. CH3COOH) dysocjują tylko częściowo, przy czym liczba cząsteczek zdysocjowanych wzrasta wraz z rozcieńczeniem roztworu; stosunek liczby cząsteczek elektrolitu, które uległy rozpadowi na jony do całkowitej liczby cząsteczek elektrolitu w roztworze nazywa się stopniem d.e. α; dla elektrolitów mocnych α = 1, dla elektrolitów słabych α < 1 i zależy od stężenia elektrolitu w roztworze; w przypadku roztworu elektrolitu słabego AB dysocjującego wg schematu AB ⇌ A+ + B– ustala się stan równowagi dynamicznej, określony, zgodnie z prawem działania mas, stałą równowagi reakcji dysocjacji elektrolitycznej, zwaną stałą dysocjacji elektrolitycznej K: 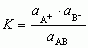 lub
lub 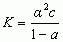 gdzie a — aktywność reagentów, α — stopień dysocjacji, c — całkowite stężenie elektrolitu. Teorię dysocjacji elektrolitycznej elektrolitów słabych podał 1887 S.A. Arrhenius; teorię elektrolitów mocnych podali 1923 P. Debye i E. Hückel.
gdzie a — aktywność reagentów, α — stopień dysocjacji, c — całkowite stężenie elektrolitu. Teorię dysocjacji elektrolitycznej elektrolitów słabych podał 1887 S.A. Arrhenius; teorię elektrolitów mocnych podali 1923 P. Debye i E. Hückel.
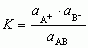 lub
lub 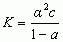 gdzie a — aktywność reagentów, α — stopień dysocjacji, c — całkowite stężenie elektrolitu. Teorię dysocjacji elektrolitycznej elektrolitów słabych podał 1887 S.A. Arrhenius; teorię elektrolitów mocnych podali 1923 P. Debye i E. Hückel.
gdzie a — aktywność reagentów, α — stopień dysocjacji, c — całkowite stężenie elektrolitu. Teorię dysocjacji elektrolitycznej elektrolitów słabych podał 1887 S.A. Arrhenius; teorię elektrolitów mocnych podali 1923 P. Debye i E. Hückel. 

