Guldberga i Waagego prawo, prawo działania mas, prawo równowagi chemicznej,
prawo określające ilościowo stan dynamicznej równowagi chemicznej osiągnięty w stałej temperaturze przez reakcję odwracalną, przebiegającą w układzie homogenicznym (jednorodnym), w fazie gazowej lub ciekłej;
Guldberga i Waagego prawo
Encyklopedia PWN
głosi: jeżeli reagujący odwracalnie układ gazowy lub ciekły osiągnie stan równowagi chem., to stosunek iloczynu stężeń molowych produktów reakcji, podniesionych do potęg równych ich współczynnikom stechiometrycznym, do iloczynu stężeń molowych substancji wyjściowych (substratów reakcji), podniesionych również do potęg równych ich współczynnikom stechiometrycznym, jest wielkością stałą, charakterystyczną dla danej reakcji (tzw. stała równowagi reakcji chem. K), niezależną od stężenia reagentów, zależną od temperatury oraz — w wypadku gazów — od ciśnienia. Na przykład dla reakcji nA + mB ⇌ rC + sD prawo Guldberga i Waagego wyraża wzór:
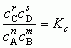
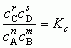
gdzie c — stężenie molowe reagenta, n, m, r, s — współczynniki stechiometryczne, Kc — stała równowagi reakcji. Prawo Guldberga i Waagego można wyrażać również za pomocą ułamków molowych (stała Kx), ciśnień cząstkowych (Kp) lub aktywności (Ka). Wartości liczbowe stałej K można oznaczyć doświadczalnie, określając metodami analit. stężenia reagentów w stanie równowagi, lub obliczyć z danych termodynamicznych. Znajomość wartości stałej K danej reakcji chem. pozwala przewidywać kierunek reakcji chem. i dobierać warunki zapewniające największy stopień przereagowania. Prawo to zostało sformułowane po raz pierwszy 1867 przez C.M. Guldberga i P. Waagego.


