równowaga chemiczna,
w ujęciu kinetycznym — stan, do którego dąży układ w miarę przebiegu reakcji odwracalnej;
równowaga chemiczna
Encyklopedia PWN
jeśli produkty reakcji nie opuszczają środowiska reakcji, reagują między sobą, odtwarzając substraty; w miarę upływu czasu szybkość reakcji odwrotnej wzrasta, a szybkość reakcji pierwotnej maleje; po wyrównaniu się szybkości układ osiąga stan dynamicznej r.ch., w którym stężenia reagentów w danych warunkach ciśnienia i temperatury nie ulegają zmianie, tj. liczby moli reagentów nie ulegają zmianie, natomiast cząsteczki substratów nieustannie tworzą cząsteczki produktów i na odwrót, cząsteczki produktów nieustannie zamieniają się w cząsteczki substratów. Zgodnie z prawem działania mas (Guldberga i Waagego prawo) wielkością charakteryzującą równowagę chemiczną jest stała równowagi K, którą dla ogólnej reakcji nA + mB ⇌ rC + sD można wyrazić równaniem 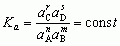
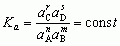
(gdzie n, m, r, s — współczynniki stechiometryczne reagentów, a — aktywności reagentów); stałą równowagi można też wyrażać za pomocą stężeń (Kc), ułamków molowych (Kx) lub ciśnień cząstkowych (Kp). Wartości równowagowych stężeń reagentów zależą od warunków, w których ustalił się stan r.ch., np. od temperatury i ciśnienia; jeśli zewn. bodziec zmieni te warunki, wytrącając układ ze stanu r.ch., w układzie zachodzą przemiany, dzięki którym zdąża on do nowego stanu r.ch. (Le Chateliera i Brauna reguła).


