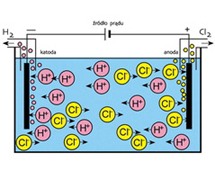
elektroliza
podstawowy proces elektrochemiczny polegający na chemicznej przemianie składników elektrolitu (a często i materiału elektrod), przebiegającej na elektrodach pod wpływem przepływu prądu elektrycznego;
[gr. ḗlektron ‘bursztyn’, lýsis ‘rozłożenie’],