ogniwo galwaniczne, ogniwo elektrochemiczne,
źródło energii elektrycznej, składające się zwykle z 2 różnych półogniw (elektroda) stykających się od strony elektrolitu bezpośrednio (jeśli elektrolit jest wspólny) albo pośrednio poprzez błonę półprzepuszczalną lub klucz elektrolityczny.
- elektroda
- czasoprzestrzeń
- Volta Alessandro Giuseppe Antonio
- ogniwo Leclanchégo
- ogniwo litowe
- siła elektromotoryczna
- akumulator elektryczny
- akumulator ołowiowy
- elektrolityczny klucz
- potencjał elektrody
- ogniwo paliwowe
- ogniwo Bunsena
- ogniwo srebrowe
- ogniwo rtęciowe
- akumulator niklowo-kadmowy
- akumulator niklowo-wodorkowy
- akumulator niklowo-żelazowy
- reakcja oksydacyjno-redukcyjna
- elektroliza
- elektrokataliza
- ogniwo wzorcowe
- potencjał dyfuzyjny
- entalpia swobodna
- ogniwo manganowo-cynkowe
- akumulator jonowolitowy
- akumulator
- ogniwo elektrochemiczne
- Clark Josiah Latimer
- Daniell John Frederic
- elektrochemia
- elektrochemia przemysłowa
- elektrolit
- elektroredukcja
- elektroutlenianie
- energia
- korozja
- ogniwo stężeniowe
- potencjał membranowy
- reakcja chemiczna
- ogniwo stężeniowe
- katoda
- anoda

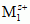 ¦
¦ 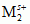 | M2; linia ciągła oznacza granicę faz elektroda (M1 lub M2) — roztwór (zawierający jony Mz+1 lub Ms+2), linia przerywana — granicę zetknięcia 2 roztworów o różnym składzie. Na elektrodach przebiegają odpowiednio reakcje: utleniania M1 =
| M2; linia ciągła oznacza granicę faz elektroda (M1 lub M2) — roztwór (zawierający jony Mz+1 lub Ms+2), linia przerywana — granicę zetknięcia 2 roztworów o różnym składzie. Na elektrodach przebiegają odpowiednio reakcje: utleniania M1 = 
