kwasy,
związki chemiczne odznaczające się charakterystycznymi właściwościami, m.in. kwaśnym smakiem, zdolnością wywoływania reakcji barwnych ze wskaźnikami (np. barwią lakmus na czerwono), roztwarzaniem wielu substancji;
kwasy
Encyklopedia PWN
właściwości te kwasy tracą w wyniku reakcji z zasadami. Wraz z rozwojem chemii starano się ustalić zależność charakterystycznych cech kwasów od budowy ich cząsteczek i formułowano coraz ogólniejsze definicje kwasów (kwasów i zasad teorie). W wypadku roztworów wodnych najczęściej wystarcza stosowanie klasycznej definicji kwasu (na podstawie teorii jonowej), wg której cząsteczka kwasu w wyniku dysocjacji elektrolitycznej tworzy tylko kation wodorowy H+ i jako anion tzw. resztę kwasową; kwasowość roztworu często jest wyrażana stężeniem jonów wodorowych 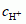 lub tzw. pH roztworu. Moc kwasu określa wartość liczbowa stałej dysocjacji elektrolitycznej. Do kwasów mocnych należą pospolite kwasy nieorganiczne (zwane zwyczajowo mineralnymi): siarkowy(VI) H2SO4, azotowy(V) HNO3, solny HCl; kwasami słabymi jest większość organicznych kwasów karboksylowych (np. octowy CH3COOH, mrówkowy HCOOH) oraz — spośród kwasów mineralnych, np. węglowy H2CO3. Kwasy mocne wypierają kwasy słabe z ich związków. Kwasy nieorganiczne o cząsteczkach zawierających atomy tlenu są zwane kwasami tlenowymi; mogą one powstawać z tlenków niemetali (tzw. bezwodników kwasowych; tworzenie się takich kwasów, jak węglowy, azotowy, w powietrzu jest źródłem kwaśnych opadów). Kwasy zawierające w cząsteczce kilka atomów wodoru, które mogą ulec wymianie na atomy metalu, noszą nazwę wieloprotonowych (wielozasadowych), np. H3PO4 jest kwasem trójprotonowym.
lub tzw. pH roztworu. Moc kwasu określa wartość liczbowa stałej dysocjacji elektrolitycznej. Do kwasów mocnych należą pospolite kwasy nieorganiczne (zwane zwyczajowo mineralnymi): siarkowy(VI) H2SO4, azotowy(V) HNO3, solny HCl; kwasami słabymi jest większość organicznych kwasów karboksylowych (np. octowy CH3COOH, mrówkowy HCOOH) oraz — spośród kwasów mineralnych, np. węglowy H2CO3. Kwasy mocne wypierają kwasy słabe z ich związków. Kwasy nieorganiczne o cząsteczkach zawierających atomy tlenu są zwane kwasami tlenowymi; mogą one powstawać z tlenków niemetali (tzw. bezwodników kwasowych; tworzenie się takich kwasów, jak węglowy, azotowy, w powietrzu jest źródłem kwaśnych opadów). Kwasy zawierające w cząsteczce kilka atomów wodoru, które mogą ulec wymianie na atomy metalu, noszą nazwę wieloprotonowych (wielozasadowych), np. H3PO4 jest kwasem trójprotonowym.
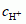 lub tzw. pH roztworu. Moc kwasu określa wartość liczbowa stałej dysocjacji elektrolitycznej. Do kwasów mocnych należą pospolite kwasy nieorganiczne (zwane zwyczajowo mineralnymi): siarkowy(VI) H2SO4, azotowy(V) HNO3, solny HCl; kwasami słabymi jest większość organicznych kwasów karboksylowych (np. octowy CH3COOH, mrówkowy HCOOH) oraz — spośród kwasów mineralnych, np. węglowy H2CO3. Kwasy mocne wypierają kwasy słabe z ich związków. Kwasy nieorganiczne o cząsteczkach zawierających atomy tlenu są zwane kwasami tlenowymi; mogą one powstawać z tlenków niemetali (tzw. bezwodników kwasowych; tworzenie się takich kwasów, jak węglowy, azotowy, w powietrzu jest źródłem kwaśnych opadów). Kwasy zawierające w cząsteczce kilka atomów wodoru, które mogą ulec wymianie na atomy metalu, noszą nazwę wieloprotonowych (wielozasadowych), np. H3PO4 jest kwasem trójprotonowym.
lub tzw. pH roztworu. Moc kwasu określa wartość liczbowa stałej dysocjacji elektrolitycznej. Do kwasów mocnych należą pospolite kwasy nieorganiczne (zwane zwyczajowo mineralnymi): siarkowy(VI) H2SO4, azotowy(V) HNO3, solny HCl; kwasami słabymi jest większość organicznych kwasów karboksylowych (np. octowy CH3COOH, mrówkowy HCOOH) oraz — spośród kwasów mineralnych, np. węglowy H2CO3. Kwasy mocne wypierają kwasy słabe z ich związków. Kwasy nieorganiczne o cząsteczkach zawierających atomy tlenu są zwane kwasami tlenowymi; mogą one powstawać z tlenków niemetali (tzw. bezwodników kwasowych; tworzenie się takich kwasów, jak węglowy, azotowy, w powietrzu jest źródłem kwaśnych opadów). Kwasy zawierające w cząsteczce kilka atomów wodoru, które mogą ulec wymianie na atomy metalu, noszą nazwę wieloprotonowych (wielozasadowych), np. H3PO4 jest kwasem trójprotonowym. 

