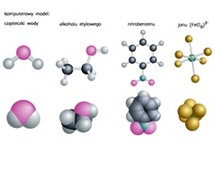
cząsteczka, molekuła, drobina,
najmniejsza trwała część substancji zachowująca właściwości chemiczne tej substancji;
cząsteczka
Encyklopedia PWN
cząsteczka to układ jąder atomowych i elektronów utrzymywanych w stanie dynamicznie stabilnym za pomocą działających między nimi sił elektrostatycznych. Oddziaływanie między określonymi atomami w cząsteczce określa się mianem wiązanie chemiczne; ma ono charakter elektronowy, tzn. powstaje dzięki elektronom, głównie elektronom zewnętrznym powłok atomu, zwanym elektronami walencyjnymi. Najprostsze cząsteczki, np. gazów szlachetnych, są jednoatomowe; cząsteczki innych pierwiastków gazowych, jak: tlen, azot, wodór, są dwuatomowe: O2, N2, H2; cząsteczka wody H2O jest trójatomowa i składa się z 2 rodzajów atomów; cząsteczki naturalnych biopolimerów, takich jak białka czy kwasy nukleinowe, a także cząsteczki syntetycznych polimerów składają się z setek tysięcy atomów — określa się je terminem makrocząsteczki. Cząsteczki zbudowane z atomów tego samego pierwiastka nazywa się cząsteczkami homojądrowymi, z atomów różnych pierwiastków — heterojądrowymi.
Wieloatomowe cząsteczki zbudowane z takiej samej liczby takich samych atomów mogą różnić się sposobem lub kolejnością powiązania atomów albo ich rozmieszczeniem w przestrzeni — nazywa się je izomerami. W niektórych przypadkach następują szybkie przemiany jednego izomeru w inny, przy czym ustala się między nimi stan równowagi dynamicznej (tautomeria).
Skład i budowę cząsteczek przedstawia się za pomocą wzorów chemicznych, a ich strukturę przestrzenną za pomocą różnych modeli, np. kulkowych, czaszowych. Określenie wzoru sumarycznego wymaga znajomości jakościowego i ilościowego składu cząsteczki; skład ten ustala się przeprowadzając analizę elementarną związku (ustalenie proporcji pierwiastków) i wyznaczając jego masę cząsteczkową (głównie wykorzystując metodę spektrometrii mas). Do ustalania rozmieszczenia w przestrzeni atomów (tj. konfiguracji cząsteczek), wiązań chemicznych i kątów między nimi, rozkładu gęstości elektronowej i rozmiarów cząsteczek (odległości międzyjądrowe są rzędu 1–2 · 10−10 m, objętość cząsteczek rzędu 10−29–10−30 m3) stosuje się m.in. badania rentgenograficzne, spektroskopowe w podczerwieni i nadfiolecie oraz metody magnetycznego rezonansu jądrowego i paramagnetycznego rezonansu elektronowego. Teorią budowy i właściwości cząsteczek zajmuje się chemia kwantowa.
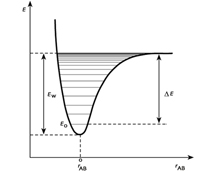
Energia potencjalna cząsteczki zależy od odległości jąder atomów wchodzących w jej skład. Stabilnemu stanowi cząsteczki odpowiada minimalna energia potencjalna.
W przypadku cząsteczek dwuatomowych na krzywej przedstawiającej zależność energii potencjalnej (E) od odległości między atomami (d) występuje minimum dla pewnej odległości, którą przyjmuje się za długość wiązania chemicznego, a wartość energii, będącą różnicą między tą wartością minimalną a energią przy nieskończenie dużej odległości między atomami — za energię wiązania (w przypadku cząsteczek wieloatomowych wartość energii potencjalnej zależy nie tylko od odległości między atomami, ale także od kątów między wiązaniami). W cząsteczce atomy wykonują ruchy oscylacyjne (drgające), rotacyjne (obrotowe) oraz translacyjne. Energia tych ruchów oraz energia stanów elektronowych wpływają na całkowitą energię cząsteczki. Energia cząsteczki (jak i wszystkie jej składowe) jest skwantowana. W warunkach normalnych cząsteczki znajdują się w elektronowym stanie podstawowym; dostarczenie określonej porcji energii (np. w postaci promieniowania elektromagnetycznego, ciepła) powoduje ich wzbudzenie, tj. przejście na wyższe poziomy elektronowe, analogicznie jak w atomie (energia tych przejść 1–10 eV), oraz zmianę poziomów oscylacyjnych (energia 0,01–1 eV) i rotacyjnych (0,00001–0,01 eV); może też spowodować jonizację cząsteczki lub jej rozpad na mniejsze fragmenty: atomy lub rodniki. Optyczne właściwości cząsteczki (oddziaływanie z promieniowaniem elektromagnetycznym) oraz ich właściwości magnetyczne (zachowanie się cząsteczek w zewnętrznym polu magnetycznym) i elektryczne (determinowane rozkładem ładunku elektrycznego w cząsteczce oraz podatnością chmury elektronowej na wpływ zewnętrznego pola elektrycznego) są wykorzystywane do ich badania.
Rodzaj cząsteczki decyduje o właściwościach fizycznych i reaktywności substancji. Indywidualne cechy cząsteczki zależą od stanu skupienia materii i są najlepiej zachowane w gazach, w których odległości między cząsteczkami są znacznie większe od wymiarów samych cząsteczek. Zgodnie z prawem Avogadra jednakowe objętości różnych gazów zawierają taką samą liczbę cząsteczek w tych samych warunkach (temperatura i ciśnienie); 1 mol substancji w stanie gazowym zajmuje objętość 22,4 dm3 w standardowych warunkach (temperatura 298,16 K, ciśnienie 1,01 · 105 Pa) i zawiera 6,0221367 · 1023 cząsteczek. Prawo Avogadra jest prawem granicznym, tzn. jest ono tym lepiej spełnione, im niższe jest ciśnienie i wyższa temperatura.
Pojęciem najmniejszej porcji „tworzywa” (dziś powiedzielibyśmy materii) posługiwali się już w starożytności Leukippos i Demokryt, uważając ją za niepodzielną i nazywając atomem. W XVII w. P. Gassendi (właściwie P. Gassend) odróżnił atom — kres wszelkich podziałów — od najmniejszej cząstki danego ciała zachowującej jego właściwości, nazywając ją molecula (zdrobnienie łacińskie moles ‘masa’). Pojęcia te ostatecznie rozróżniono dzięki pracom S. Cannizzaro przedstawionym 1860 na I Kongresie Chemików w Karlsruhe, określając terminem cząsteczki najmniejszą cząstkę związku chemicznego lub pierwiastka biorącą udział w reakcji chemicznej.