ciecz,
fiz. jeden z 3 podstawowych stanów skupienia materii — pośredni między stanem gazowym i stałym.
ciecz
Encyklopedia PWN
Substancja w tym stanie nie ma własnego kształtu, a przyjmuje kształt naczynia, w którym jest umieszczona, wypełniając go do pewnego poziomu; tworzy się przy tym (na granicy z fazą gazową) powierzchnia swobodna cieczy. Ciecz poddana działaniu sił zewnętrznych zachowuje zwykle swoją objętość (odznacza się małą ściśliwością). Wykazuje uporządkowanie bliskiego zasięgu, największe w pobliżu temperatury krzepnięcia i szybko zmniejszające się ze wzrostem temperatury. Odległości międzycząsteczkowe w cieczy są bliskie odległościom w ciałach stałych.
Powierzchnia swobodna cieczy ma właściwości napiętej cienkiej sprężystej błony; wiąże się to z występowaniem sił napięcia powierzchniowego i wynika z istnienia oddziaływań międzycząsteczkowych; cząsteczki warstw powierzchniowych słabiej oddziałują z cząsteczkami fazy gazowej niż z cząsteczkami cieczy i na granicy faz pojawia się nieskompensowana siła skierowana w głąb cieczy; powoduje to także występowanie w cieczy tzw. ciśnienia wewnętrznego; do wyprowadzenia cząsteczek z głębi cieczy na powierzchnię jest konieczne wykonanie pracy przeciw ciśnieniu wewnętrznemu; napięcie powierzchniowe jest równe pracy związanej z przeniesieniem cząsteczek z głębi cieczy i wytworzeniem jednostkowej powierzchni rozdziału 2 faz; jeżeli powierzchnia cieczy jest ograniczona (np. warstwa roztworu mydła otoczona metalową ramką), to napięcie powierzchniowe jest liczbowo równe sile działającej na jednostkę długości obwodu tej powierzchni i skierowanej prostopadle do niego (tzw. współczynnik napięcia powierzchniowego, równy np. dla wody 0,076 N/m, dla rtęci 0,48 N/m); z napięciem powierzchniowym jest związany m.in. kulisty kształt kropel, powstawanie menisku, piany, zjawiska kapilarne.
Pod względem właściwości ciecze są zwykle izotropowe (izotropia), istnieją też ciecze (zwane ciekłymi kryształami), wykazujące specyficzne uporządkowanie dalekiego zasięgu i anizotropię właściwości.
W cieczy nieruchomej na dowolną powierzchnię wewnątrz cieczy i na powierzchnie ją ograniczające działają siły skierowane prostopadle do nich (naprężenia normalne, liczbowo równe ciśnieniu). Pod działaniem sił zewnętrznych wywołujących odkształcenie postaciowe, tj. zmianę wzajemnego położenia elementów określonej masy cieczy (np. wzajemne przesuwanie się równoległych warstw cieczy), pojawiają się naprężenia styczne; cecha cieczy polegająca na zdolności do przenoszenia tych naprężeń jest zwana lepkością; jest ona związana z wymianą pędu pomiędzy przylegającymi do siebie warstwami cieczy i zachodzi podczas przechodzenia cząsteczek z jednej warstwy do drugiej; współczynnik lepkości dynamicznej μ jest określony wzorem Newtona: τ = μ(∂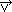 /∂
/∂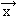 ), gdzie τ — naprężenie styczne, ∂
), gdzie τ — naprężenie styczne, ∂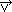 /∂
/∂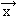 — gradient prędkości w kierunku normalnym do kierunku przepływu. Ciecze stosujące się do tego wzoru są zwane cieczami newtonowskimi (np. woda); współczynnik μ zależy dla nich jedynie od rodzaju cieczy, temperatury i ciśnienia; w przypadku tzw. cieczy nienewtonowskich (np. oleje maszynowe w niskich temperaturach) μ zależy także od wielu innych czynników, m.in. od przyłożonej z zewnątrz siły. Lepkość cieczy wzrasta z obniżaniem temperatury. W niektórych rozważaniach teoretycznych wprowadza się model cieczy idealnej (nielepkiej), w której nie występują naprężenia styczne.
— gradient prędkości w kierunku normalnym do kierunku przepływu. Ciecze stosujące się do tego wzoru są zwane cieczami newtonowskimi (np. woda); współczynnik μ zależy dla nich jedynie od rodzaju cieczy, temperatury i ciśnienia; w przypadku tzw. cieczy nienewtonowskich (np. oleje maszynowe w niskich temperaturach) μ zależy także od wielu innych czynników, m.in. od przyłożonej z zewnątrz siły. Lepkość cieczy wzrasta z obniżaniem temperatury. W niektórych rozważaniach teoretycznych wprowadza się model cieczy idealnej (nielepkiej), w której nie występują naprężenia styczne.
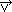 /∂
/∂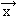 ), gdzie τ — naprężenie styczne, ∂
), gdzie τ — naprężenie styczne, ∂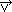 /∂
/∂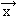 — gradient prędkości w kierunku normalnym do kierunku przepływu. Ciecze stosujące się do tego wzoru są zwane cieczami newtonowskimi (np. woda); współczynnik μ zależy dla nich jedynie od rodzaju cieczy, temperatury i ciśnienia; w przypadku tzw. cieczy nienewtonowskich (np. oleje maszynowe w niskich temperaturach) μ zależy także od wielu innych czynników, m.in. od przyłożonej z zewnątrz siły. Lepkość cieczy wzrasta z obniżaniem temperatury. W niektórych rozważaniach teoretycznych wprowadza się model cieczy idealnej (nielepkiej), w której nie występują naprężenia styczne.
— gradient prędkości w kierunku normalnym do kierunku przepływu. Ciecze stosujące się do tego wzoru są zwane cieczami newtonowskimi (np. woda); współczynnik μ zależy dla nich jedynie od rodzaju cieczy, temperatury i ciśnienia; w przypadku tzw. cieczy nienewtonowskich (np. oleje maszynowe w niskich temperaturach) μ zależy także od wielu innych czynników, m.in. od przyłożonej z zewnątrz siły. Lepkość cieczy wzrasta z obniżaniem temperatury. W niektórych rozważaniach teoretycznych wprowadza się model cieczy idealnej (nielepkiej), w której nie występują naprężenia styczne. Przy wzroście temperatury, pod stałym ciśnieniem, objętość prawie wszystkich cieczy wzrasta; anomalną rozszerzalność wykazuje m.in. woda, której objętość w zakresie temperatur 0–4°C maleje ze wzrostem temperatury. Przewodnictwo elektryczne czystych cieczy jest na ogół małe; wyjątek stanowią ciekłe metale i stopione sole.
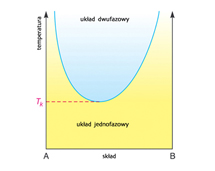
Przy ustalonym ciśnieniu substancja może występować w stanie ciekłym w pewnym zakresie temperatur; zakres ten jest wyznaczony z jednej strony przez temperaturę krzepnięcia, z drugiej — przez temperaturę wrzenia. Krzepnięcie (krystalizacja) rozpoczyna się w otoczeniu występujących w cieczy niejednorodności, tzw. zarodzi krystalizacji (np. zanieczyszczeń), i czasami, kiedy brak jest w cieczy zarodzi, można ją ochłodzić poniżej temperatury krzepnięcia (ciecz przechłodzona). Niektóre ciecze o dużej lepkości nie krystalizują, lecz przechodzą w bezpostaciowe ciało stałe. W dowolnej temperaturze, zwłaszcza na powierzchni cieczy, występuje zawsze pewna liczba cząsteczek o energii wystarczającej do pokonania sił przyciągania ze strony innych cząsteczek i przejścia z fazy ciekłej do fazy gazowej; przestrzeń nad cieczą wypełnia się jej parą i po pewnym czasie wytwarza się w danej temperaturze stan równowagi dynamicznej — liczba cząsteczek przechodzących w jednostce czasu z cieczy do fazy gazowej (parowanie) jest taka sama jak przechodzących z fazy gazowej do cieczy (skraplanie); para, zwana wówczas parą nasyconą, ma najwyższe w danej temperaturze ciśnienie (prężność pary nasyconej). Kiedy ciśnienie to osiąga wartość ciśnienia zewnętrznego, następuje wrzenie cieczy, tj. parowanie w całej jej objętości; niekiedy można ciecz ogrzać powyżej temperatury wrzenia (ciecz przegrzana). Ciśnienie pary nasyconej rośnie wraz z temperaturą, przy czym krzywa tej zależności kończy się w tzw. punkcie krytycznym (stan krytyczny), w którym zanika zarówno ciecz, jak i para nasycona; punkt krytyczny określa najwyższą możliwą temperaturę wrzenia (pod ciśnieniem krytycznym); powyżej tej temperatury substancja może istnieć tylko w fazie gazowej.
Wszystkie substancje jednoskładnikowe mają jedną fazę ciekłą, z wyjątkiem helu występującego w 2 fazach ciekłych. W mechanice płynów ciecze wraz z gazami są nazywane płynami.