Atomami centralnymi mogą być kationy pierwiastków przejściowych, np. Co3+, Pt4+, Cu2+, lub pierwiastków mających elektrony walencyjne na orbitalach s i p, np. B3+, Si4+, Sb5+, S6+, albo obojętne atomy, np. Ni, a ligandami — aniony, rzadko kationy, także obojętne cząsteczki nieorg. lub org., np. Cl–, OH–, NO3–, CN–, N2H5+, CO, H2O, NH3, C5H5N. Liczba miejsc koordynacyjnych dookoła jonu centralnego to liczba koordynacyjna; najczęściej są spotykane kompleksy o liczbie koordynacyjnej od 2 do 8, rzadziej 9, 10 i 12. Liczba koordynacyjna decyduje o strukturze związku koordynacyjnego. Atom centralny stanowi centrum koordynacji odpowiedniego układu płaskiego lub przestrzennego zw. figurą koordynacyjną. Wiązanie koordynacyjne jest wiązaniem donorowo-akceptorowym (donorem pary elektronów jest ligand, akceptorem — atom centralny); do jego utworzenia jest konieczny udział pary elektronowej i podpowłoki elektronowej (zw. także orbitalem) liganda oraz podpowłok d, s, p atomu centralnego (orbital). W związkach koordynacyjnych występują wiązania typu σ lub typu π. Wiązanie σ tworzy para elektronów pochodząca od atomu donora. Wiązanie π może być skierowane od liganda π-donorowego do atomu centralnego lub, gdy atom centralny ma zapełnione orbitale d (jak u platynowców), od atomu centralnego do liganda π-akceptorowego. Ligandami π-akceptorowymi, mającymi niezapełnione orbitale π, są np. CO, CN–, alkeny. Specyficznym rodzajem wiązania jest wiązanie polegające na uwspólnieniu elektronów π przez cząsteczkę org. (ligand) i atom centralny. Wiązania tego typu występują w tzw. kompleksach π (zw. też metalocenami, kompleksami sandwiczowymi), np. w ferrocenie Fe(C5H5)2 — kompleksie żelaza z cyklopentadienylem. Ligandy zawierające więcej niż jeden atom donorowy mogą zajmować 2 lub więcej miejsc koordynacyjnych; są to tzw. ligandy kleszczowe, np. C2O42–, NH2CH2COO–, kwas etylenodiaminotetraoctowy (EDTA), zw. kwasem wersenowym; tworzą one bardzo trwałe kompleksy, zw. chelatami lub kompleksami chelatowymi, mające zwykle budowę 5- lub 6-członowych pierścieni, np. glicynian miedzi: 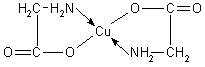
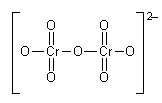
Oprócz kompleksów jednordzeniowych, zawierających 1 jon centralny, istnieją kompleksy 2- lub wielordzeniowe, zawierające 2 lub więcej jonów centralnych połączonych mostkami. Grupy mostkowe mogą się składać z jednego atomu: –O–, –S–, lub większej liczby atomów: –NH2–, –OH–, –CO–, –NO2–; mostków może być 1, 2 lub więcej:
2 tetraedry o wspólnym narożu
2 tetraedry o wspólnej krawędzi
W związkach koordynacyjnych, w których atom centralny jest związany z kilkoma różnymi ligandami, występuje
izomeria, uwarunkowana możliwością zajmowania przez ligandy różnych położeń w kompleksie; np. diaminadichloroplatyna istnieje w 2 odmianach —
cis i
trans:
Miarą trwałości związku koordynacyjnego jest stała trwałości βn, będąca stałą równowagi reakcji tworzenia związku koordynacyjnego w danym rozpuszczalniku (M + nL ⇌ MLn):
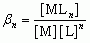
,
gdzie [M] — stężenie jonu metalu, [L] — stężenie ligandu, [MLn] — stężenie związku koordynacyjnego, n — liczba ligandów w cząsteczce związku koordynacyjnego. Często stosuje się stałą nietrwałości Kn = 1/βn. Kompleksy chelatowe są znacznie trwalsze niż związki koordynacyjne z ligandami prostymi.
Do opisu budowy i właściwości z.k. wykorzystuje się kilka teorii. Teoria wiązań walencyjnych zakłada
hybrydyzację walencyjnych orbitali
d,
s,
p atomu centralnego, co tłumaczy kierunkowość wiązań i budowę przestrzenną związku koordynacyjnego. W teorii pola ligandów rozpatruje się elektrostat. oddziaływania ligandów, które mają trwały ładunek ujemny (np. CN
–, Cl
–, F
–) albo pewien moment dipolowy, na orbitale
d jonu centralnego. Metoda orbitali molekularnych (MO) jako najbardziej ogólna przyczyniła się w dużym stopniu do rozwoju teorii struktury z.k.; uwzględnia ona ilościowy udział w wiązaniu zarówno orbitali jonu centralnego, jak i orbitali ligandów oraz rozpatruje wszystkie elektrony jako należące do całego kompleksu (
orbitali molekularnych metoda).
Związki koordynacyjne mają duże i stale wzrastające znaczenie w wielu działach technologii i techniki. Znajdują zastosowanie m.in. w analizie chem., w procesach wymiany jon., w ekstrakcji, do rozdzielania i wydzielania metali w hydrometalurgii, w przerobie paliwa wypalonego w reaktorach jądr. oraz jako aktywne katalizatory w przem. syntezie organicznej. Dobór rodzaju i liczby atomów centralnych oraz dobór ligandów, a także stosowanie ligandów mieszanych umożliwia otrzymywanie nieograniczonej liczby związków koordynacyjnych i uzyskiwanie substancji o żądanych właściwościach. Związki koordynacyjne mogą być również stosowane jako materiały elektroniczne w technice laserowej, magnetyki i in. Związki koordynacyjne odgrywają bardzo ważną rolę w funkcjonowaniu organizmów żywych; do tej grupy związków należą: pigmenty oddechowe (np. hemoglobina, mioglobina), układy przenoszące elektrony (np. cytochromy), układy biorące udział w fotosyntezie (chlorofil), metaloenzymy pośredniczące w metabolizmie białek (kompleksy metali z peptydami i kwasami nukleinowymi). Pierwszą ogólną teorię budowy z.k. opracował (1891–93) A. Werner, który wprowadził m.in. pojęcie jonu centralnego.


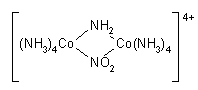
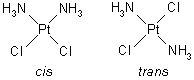
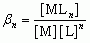 ,
,
