struktura białek
Encyklopedia PWN
w opisie struktura białek rozróżnia się zwykle: strukturę pierwszorzędową, drugorzędową, trzeciorzędową i czwartorzędową. Struktura pierwszorzędowa opisuje kolejność, w której reszty aminokwasowe są połączone ze sobą wiązaniami kowalencyjnymi (sekwencja aminokwasów), z uwzględnieniem wiązań kowalencyjnych między grupami funkcyjnymi łańcuchów bocznych; wiązania takie mogą się tworzyć z udziałem reszt aminokwasowych, występujących w tym samym łańcuchu lub w różnych łańcuchach polipeptydowych; do najczęściej występujących należą wiązania między 2 atomami siarki (wiązanie disiarczkowe, zw. również mostkiem disiarczkowym) powstające w wyniku utlenienia 2 łańcuchów bocznych cysteiny; struktura pierwszorzędowa ma zasadnicze znaczenie w kształtowaniu struktur o wyższej rzędowości; jest w niej zawarta informacja o rozmieszczeniu w przestrzeni wszystkich atomów cząsteczki danego białka — czyli o jego stereochemii. Budowa przestrzenna białka jest uwarunkowana 2 najważniejszymi założeniami: 1) wiązanie peptydowe –CO–NH– ma częściowo charakter wiązania podwójnego, co powoduje, że wszystkie atomy wiązania peptydowego znajdują się w jednej płaszczyźnie i nie mogą ulegać rotacji wokół niego, natomiast wokół pozostałych wiązań łańcucha polipeptydowego może zachodzić swobodna rotacja; 2) zarówno grupy –CO–, jak i –NH– są zdolne do tworzenia między sobą wiązań wodorowych (pierwsza jest akceptorem, druga donorem atomu wodoru), a ich powstawanie jest energetycznie korzystne.
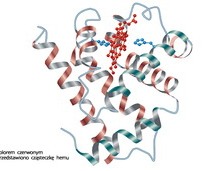
Struktura drugorzędowa, opisująca przestrzenne ułożenie reszt aminokwasowych łańcucha polipeptydowego, odnosi się do tych fragmentów cząsteczki białka, w których wszystkie grupy –CO– i –NH– uczestniczą w tworzeniu wiązań wodorowych; mogą one powstawać zarówno wewnątrz jednego łańcucha, jak i między wieloma łańcuchami polipeptydowymi, tworząc struktury regularne; najczęściej spotykaną strukturą, wytworzoną z udziałem wiązań wodorowych między grupami –CO– i –NH– tego samego łańcucha, jest prawoskrętna spirala, tzw. α-heliks; skok spirali w tym przypadku wynosi 0,54 nm i zawiera 3,6 reszt aminokwasowych, średnica spirali — 0,50 nm. Przykładem struktury utworzonej z udziałem grup –CO– i –NH– należących do odrębnych łańcuchów polipeptydowych jest struktura β, tzw. struktura pofałdowanej kartki; tworzy ją wiele łańcuchów (prawie całkowicie rozciągniętych) ułożonych względem siebie równolegle lub antyrównolegle; znaczny udział struktury β stwierdzono w fibroinie jedwabiu. Łańcuchy o dużej zawartości reszt prolinowych wytwarzają regularne struktury spiralne, które są stabilizowane innymi siłami niż wiązania wodorowe, np. heliks poliproliny powstaje dzięki sterycznemu oddziaływaniu pirolidynowych pierścieni proliny; jest on bardziej rozciągnięty niż α-heliks. Zbudowane podobnie jak heliks poliproliny 3 łańcuchy polipeptydowe, owinięte wokół siebie, tworzą strukturę cząsteczki kolagenu (tzw. superhelikalną); przypomina ona sztywną linę i odznacza się dużą wytrzymałością; struktura ta jest stabilizowana międzyłańcuchowymi wiązaniami wodorowymi, oddziaływaniem pomiędzy pierścieniami pirolidynowymi proliny, a także wiązaniami kowalencyjnymi między łańcuchami bocznymi reszt aminokwasowych, występujących w różnych łańcuchach głównych. Struktury regularne (drugorzędowe) nie zawsze obejmują całą cząsteczkę białka; istnieją obszary, w których regularność jest zakłócona, np. występowanie reszty proliny nie zawierającej atomów wodoru, który mógłby uczestniczyć w tworzeniu wiązania wodorowego, przerywa regularność struktury α-heliksu; podobny efekt wywołuje elektrostatyczne oddziaływanie zjonizowanych grup występujących w łańcuchach bocznych; zakłócenia w regularności spirali umożliwiają powstawanie małych fragmentów struktur β (tzw. β-zwój) zbud. z reszt aminokwasowych tego samego łańcucha i powodują wyginanie łańcucha polipeptydowego; w wyniku tych zjawisk zawartość struktury regularnej w cząsteczkach wielu białek wynosi od 10 do 75%, a cząsteczki takich białek mają kształt kłębka (białka globularne), np. mioglobina; struktura opisująca wszystkie nieregularności występujące w budowie cząsteczki jest zw. strukturą trzeciorzędową. Niektóre białka, mające cząsteczki złożone z 2 lub więcej oddzielnych łańcuchów polipeptydowych, wytwarzają strukturę czwartorzędową; opisuje ona sposób wzajemnego dopasowania się poszczególnych łańcuchów z wytworzeniem agregatów zawierających identyczne lub różne łańcuchy polipeptydowe, między którymi nie występują wiązania kowalencyjne; przykładem białka wytwarzającego strukturę czwartorzędową jest hemoglobina składająca się z 4, parami identycznych łańcuchów, upakowanych w formie tetraedru (czworościanu).