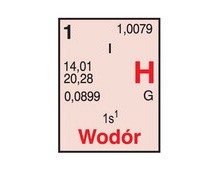
wodór, H, hydrogenium,
pierwiastek o liczbie atomowej 1;
Symbol: H
Nazwa łacińska: Hydrogenium
Liczba atomowa: 1
Pierwiastek promieniotwórczy: nie
Odkrycie: 1766
Odkrywca: Cavendish Henry
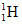 (prot) oraz wodór ciężki
(prot) oraz wodór ciężki 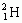 i
i 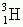 (deuter, tryt); gaz bezbarwny, bezwonny, słabo rozpuszczalny w wodzie, najlżejszy ze wszystkich pierwiastków; temperatura topnienia –259,14°C, temperatura wrzenia –252,87°C, gęstość 0,08988 g/dm3; tworzy cząsteczki dwuatomowe H2, występujące w 2 odmianach (ortowodór i parawodór); spośród gazów jest najlepszym przewodnikiem ciepła; łatwo dyfunduje przez materiały porowate; jest pochłaniany przez niektóre metale (np. pallad, nikiel); szczególnie reaktywny jest wodór in statu nascendi [łac. ‘w chwili powstania’], zwykłe reakcje z wodorem wymagają ogrzewania; ma właściwości silnie redukujące; palny, z tlenem tworzy mieszaninę wybuchową; reaguje bezpośrednio z fluorem, z chlorem — podczas naświetlania (obie reakcje przebiegają gwałtownie), po ogrzaniu łączy się z azotem, siarką, niektórymi metalami; występuje na I, niekiedy −I stopniu utlenienia.
(deuter, tryt); gaz bezbarwny, bezwonny, słabo rozpuszczalny w wodzie, najlżejszy ze wszystkich pierwiastków; temperatura topnienia –259,14°C, temperatura wrzenia –252,87°C, gęstość 0,08988 g/dm3; tworzy cząsteczki dwuatomowe H2, występujące w 2 odmianach (ortowodór i parawodór); spośród gazów jest najlepszym przewodnikiem ciepła; łatwo dyfunduje przez materiały porowate; jest pochłaniany przez niektóre metale (np. pallad, nikiel); szczególnie reaktywny jest wodór in statu nascendi [łac. ‘w chwili powstania’], zwykłe reakcje z wodorem wymagają ogrzewania; ma właściwości silnie redukujące; palny, z tlenem tworzy mieszaninę wybuchową; reaguje bezpośrednio z fluorem, z chlorem — podczas naświetlania (obie reakcje przebiegają gwałtownie), po ogrzaniu łączy się z azotem, siarką, niektórymi metalami; występuje na I, niekiedy −I stopniu utlenienia. Do najważniejszych związków wodoru należą m.in.: woda, nadtlenek wodoru, fluorowcowodory, amoniak, siarkowodór, wodorki metali, węglowodory i wiele innych związków organicznych.
Atomy wodoru są atomami najbardziej rozpowszechnionymi w Układzie Słonecznym, stanowiąc ok. 91% wszystkich atomów, a zarazem 71% jego masy. Konwersja wodoru w hel stanowi główne źródło energii wysyłanej przez Słońce. Wodór w stanie wolnym występuje w małych ilościach w gazach wulkanicznych i w ilościach śladowych w atmosferze ziemskiej; w stanie związanym jest bardzo rozpowszechniony; najpospolitszy związek wodoru — woda, oraz liczne związki organiczne stanowią podstawowe składniki materii. W przemyśle wodór jest otrzymywany głównie w reakcji pary wodnej z węglowodorami, przede wszystkim z metanem zawartym w gazie ziemnym, a także jako produkt uboczny krakingu węglowodorów oraz w procesie elektrolizy roztworów chlorku sodu; w laboratorium zwykle otrzymuje się go przez działanie kwasów na metale nieszlachetne. Największe ilości wodoru są używane do syntezy amoniaku, a także do utwardzania tłuszczów roślinnych oraz uwodorniania węglowodorów nienasyconych i aromatycznych; mieszanina wodoru z tlenkiem węgla jest surowcem w licznych katalitycznych syntezach przemysłowych (gaz syntezowy). Wodór był używany do napełniania balonów; w stanie skroplonym jest stosowany jako paliwo rakietowe; rozważane są możliwości szerokiego wykorzystania wodoru jako paliwa nie dającego po spaleniu produktów szkodliwych dla środowiska naturalnego. Wydzielanie się wodoru jako palnego gazu w reakcji żelaza i kwasu solnego obserwował w 2. połowie XVII w. R. Boyle; H. Cavendish (1766) stwierdził, że w czasie spalania wodoru powstaje woda; A. Lavoisier (1781) wykazał, że wodór jest pierwiastkiem chemicznym.