Dla każdego pierwiastka chemicznego znanych jest kilka (pierwiastki lekkie), kilkanaście lub nawet kilkadziesiąt izotopów (pierwiastki ciężkie); np. dla radu jest znanych obecnie ok. 30 izotopów. Tylko niektóre z izotopów są trwałe (najwięcej izotopów trwałych, 10, ma cyna), a pozostałe samorzutnie się rozpadają (izotopy promieniotwórcze). Niektóre pierwiastki chemiczne nie mają w ogóle izotopów trwałych (
transuranowce). Izotopy tego samego pierwiastka mają różne właściwości (różne masy, rozmiary, całkowite energie wiązania, spiny, rodzaje statystyki, momenty magnetyczne itd.), co z kolei powoduje pewne różnice właściwości fizycznych substancji o odmiennych składach izotopowych (
izotopowe efekty); te niewielkie różnice właściwości fizycznych wykorzystuje się do rozdzielania izotopów (separacja izotopów) oraz rozdzielania substancji, w których skład one wchodzą. Pierwiastki występujące w przyrodzie stanowią mieszaninę o prawie stałym składzie izotopowym, tj. o prawie stałym stosunku ilościowym poszczególnych izotopów trwałych. Izotopy promieniotwórcze są szeroko stosowane w wielu dziedzinach nauki, techniki, w medycynie, głównie jako wskaźniki izotopowe (
izotopowych wskaźników metoda), a także jako źródła promieniowania jądrowego m.in.: w radioterapii, defektoskopii, kontroli procesów przemysłowych, do automatycznej regulacji procesów technologicznych, w ogniwach izotopowych, analizie aktywacyjnej, a także do sterylizacji, określania wieku substancji (
datowanie izotopowe). Odkrycie zjawiska
izotopii wiąże się z odkryciem promieniotwórczości; termin „izotopy” wprowadził F. Soddy, natomiast istnienie izotopów stwierdził doświadczalnie J.J. Thomson (1913).
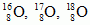 (każdy ma 8 protonów).
(każdy ma 8 protonów).